Эритроциты не пассажиры: новый взгляд на свёртывание крови
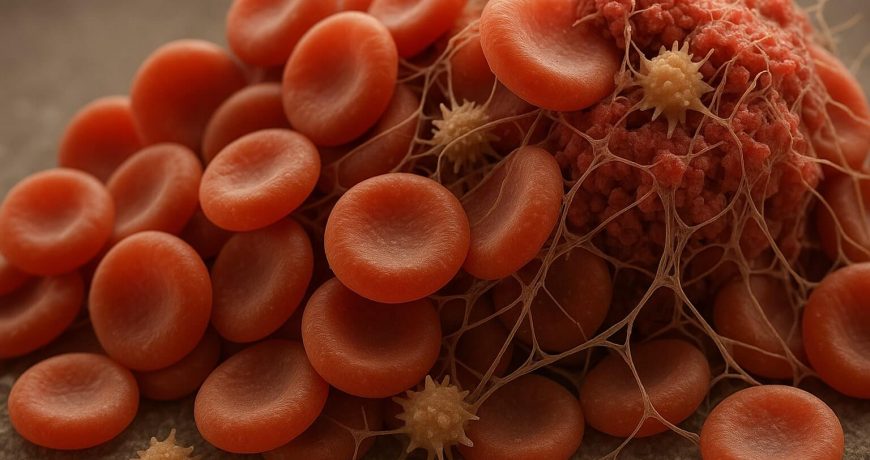
Классическая картина финальной фазы гемостаза такова: активированные тромбоциты с помощью актино‑миозинового «двигателя» тянут за фибриновые волокна, сжимая сгусток. Новые данные добавляют третий актёр — эритроциты. При повышенном гематокрите («больше эритроцитов в объёме») в сгустке возрастает число точек контакта «эритроцит–фибрин», и клетки действуют как мягкие опорные элементы, перераспределяя нагрузку и помогая тромбоцитам довести «утяжеление» тромба до более плотной упаковки.
В экспериментах с микрофлюидными каналами и 3D‑матрицами фибрина исследователи визуализировали динамику сгустка конфокальной микроскопией, метили эритроциты и фибрин флуоресцентными красителями и измеряли тяговые усилия тромбоцитов (traction force) с помощью деформируемых подложек. С наращиванием доли эритроцитов регистрировали более высокую скорость и степень сокращения, а также снижение пористости сгустка. Параллельно моделирование показало, что включение эритроцитов в матрицу ведёт к нелинейному росту жёсткости, когда каждая дополнительная клетка усиливает общий отклик сильнее предыдущей.
От лаборатории — к пациенту: клинические контексты
Новые механические роли эритроцитов объясняют ряд клинических наблюдений:
- При полицитемии (высокий гематокрит) сгустки становятся жёстче и плотнее, что повышает риск тромбоэмболий.
- При гемоглобинопатиях (например, серповидноклеточная анемия) и диабете эритроциты туже и менее деформируемы — это ухудшает их прохождение по микрососудам и может усиливать местное тромбообразование и ишемию.
- При воспалении и гипоксии красные клетки выделяют микровезикулы с внешне экспонированным фосфатидилсерином — они служат прокоагулянтной платформой, ускоряя каскад свертывания.
- В острых инфекциях (включая COVID‑19) изменения реологии крови и активация эритроцитов коррелируют с микрососудистыми тромбозами, что согласуется с ролью эритроцитов как механо‑регуляторов тромба.
Для практики это означает, что к привычным показателям (тромбоциты, ПТИ/МНО, фибриноген, D‑димер) стоит добавлять параметры, отражающие эритроцитарную механику — гематокрит, индексы деформируемости (например, по эктасициометрии), маркёры микровезикул. Это поможет стратифицировать риск кровотечений и тромбозов и точнее подбирать дозы антикоагулянтов/антиагрегантов.
Где границы и что дальше
Авторы подчёркивают, что описанные эффекты зависят от состава плазмы, скорости сдвига и архитектуры фибриновой сети: в крупных артериях с высокой скоростью потока вклад эритроцитов может отличаться от микрососудов. Остаются вопросы о молекулярных «якорях» контактирования (участие гликопротеинов мембраны эритроцитов, плазменных мостиков вроде фибриногена) и о том, как модификации мембраны при хронических болезнях меняют масштаб макропоследствий. Следующий шаг — стандартизованные биомеханические тесты сокращения тромба с контролируемой долей эритроцитов и проспективные исследования связи этих метрик с клиническими исходами.
Что это может изменить в практике (кратко):
- оценка гематокрита и деформируемости эритроцитов как факторов риска кровотечений/тромбозов;
- учёт вклада эритроцитарных микровезикул в коагуляцию и воспаление;
- адаптация антикоагулянтной терапии с оглядкой на реологию крови и «жёсткость» сгустка;
- развитие биомеханических тестов для измерения силы сокращения тромба с учётом эритроцитов.



